近日,我校生物工程学院王启要教授课题组在病原菌毒力调控方面取得新进展。相关研究成果以“Lysine acetylation regulates the AT-rich DNA possession ability of H-NS”为题,发表于生物学Top期刊《核酸研究》(Nucleic Acids Research,IF=14.9)。
如果将原始的细菌基因组比作细菌内部的原住民,那么细菌的进化主要就是伴随着水平基因转移元件(入侵者)不断融合到原住民之间,赋予或增强细菌致病性和环境适应性等特性。典型的入侵者,如三型分泌系统(T3SS)、六型分泌系统(T6SS)、抗性基因和原噬菌体,能够加速普通细菌向病原菌跃迁。然而,这些入侵者会侵占原住民的生存资源,原住民派出守卫者类组蛋白H-NS沉默入侵者的表达。当病原菌需要入侵者如T3/T6SS发挥功能时,需要抵抗守卫者H-NS介导的沉默。研究团队先前报道了原噬菌体来源的抗沉默蛋白EnrR可以直接驱逐H-NS,激活T3/T6SS表达(Nucleic Acids Research, 2022)。进一步,类组蛋白H-NS自身是否会发生类似组蛋白的翻译后修饰,从而转变对入侵者的沉默状态,即是该研究的关键问题。
研究团队以海洋鱼类病原菌杀鱼爱德华氏菌为模式菌株,发现赖氨酸乙酰化修饰调控H-NS对T3/T6SS的沉默,提出赖氨酸乙酰化是一种抗H-NS沉默机制。杀鱼爱德华氏菌响应环境中的氨基酸营养或免疫代谢物水平后,调整H-NS的赖氨酸乙酰化修饰状态。其中K120位点乙酰化削弱了H-NS对高AT DNA的占有能力,这些高AT DNA集中在水平基因转移元件的启动子区域。最终,失去占有能力的H-NS更容易被抗沉默蛋白驱逐,彻底解除对T3/T6SS的沉默状态。这一研究成果拓展了对H-NS调控水平基因转移元件的认知,为深入理解杀鱼爱德华氏菌的致病机制奠定了理论基础。
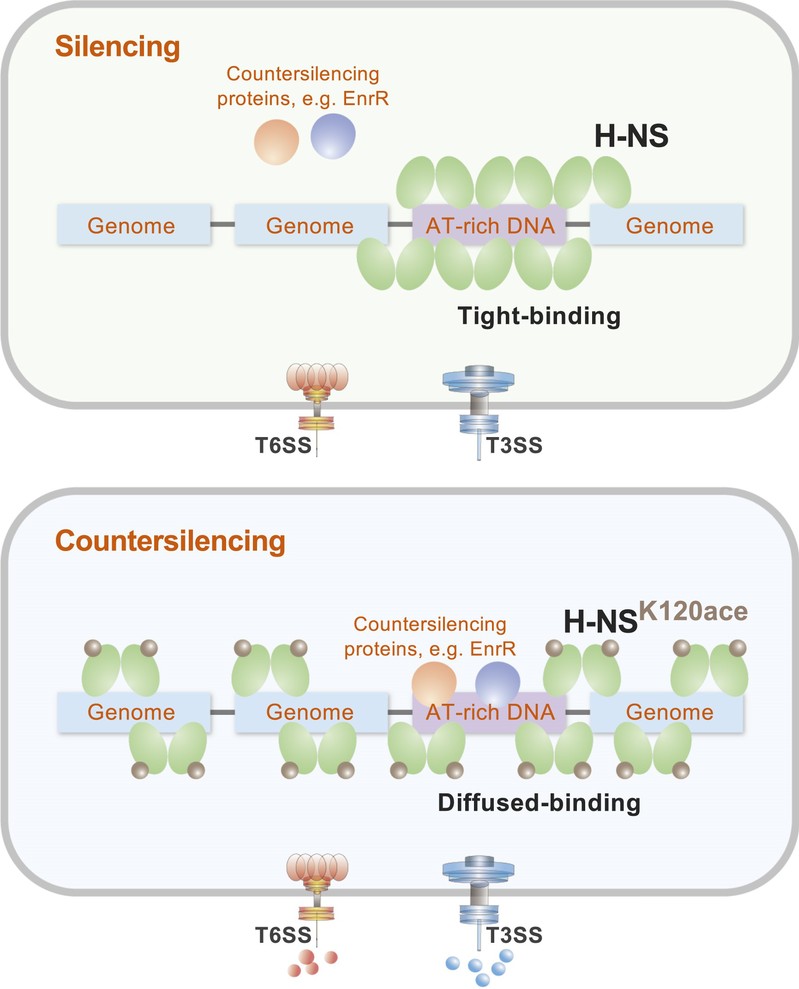
图片说明:赖氨酸乙酰化影响H-NS对高AT DNA的占有能力
我校生物工程学院博士研究生刘亚博为论文第一作者,邵帅讲师为该论文的通讯作者。研究工作得到生物工程学院王启要教授和刘琴教授的大力支持,并获得国家自然科学基金和国家现代农业产业技术体系等项目的资助。
原文链接:https://doi.org/10.1093/nar/gkad1172
新闻来源:华理新闻网
新闻链接:https://news.ecust.edu.cn/2024/0329/c6a179073/page.htm







