近日,我校生物工程学院、生物反应器工程国家重点实验室刘琴教授课题组在细胞焦亡进化起源方面取得了重要进展,首次在模式动物水螅中解析了动物界中的祖先细胞焦亡信号通路并揭示了其保守的抗感染功能,相关成果以“Caspase-mediated LPS sensing and pyroptosis signalling in Hydra”为题在线发表于Science子刊《科学进展》(Science Advances)。
细胞焦亡是继细胞凋亡之后新发现的一类细胞程序性死亡类型。细胞焦亡的发生依赖于关键的执行分子,即gasdermin (GSDM) 家族蛋白。在被上游信号分子切割活化后,它释放出活性的N端结构域。该结构域具有结合膜脂并在细胞膜上打孔的活性,导致细胞渗透压的变化,引起细胞胀大直至最终细胞膜破裂,促进细胞内容物的释放并引发剧烈的炎症反应。细胞焦亡是机体重要天然免疫反应,在拮抗感染和内源危险信号中发挥重要作用。同时,细胞焦亡也广泛参与感染性疾病、神经系统相关疾病和动脉粥样硬化性疾病等的发生发展,对细胞焦亡的深入研究有助于认识其在相关疾病发生发展中的作用,为临床防治提供新思路。在前期研究中,我们发现了细胞焦亡信号通路能够感知细菌溶血素异常的表达,促进机体对病原体的清除。我们还发现,除哺乳动物外,在硬骨鱼中也存在保守的细胞焦亡信号通路,并能响应感染信号,发挥保守的抗感染免疫功能。这些研究说明细胞焦亡信号通路在脊椎动物中的保守性。然而,迄今为止,在动物界数量更为庞大、种类更为繁多且更古老的无脊椎动物中,是否存在着细胞焦亡信号通路尚不清楚。
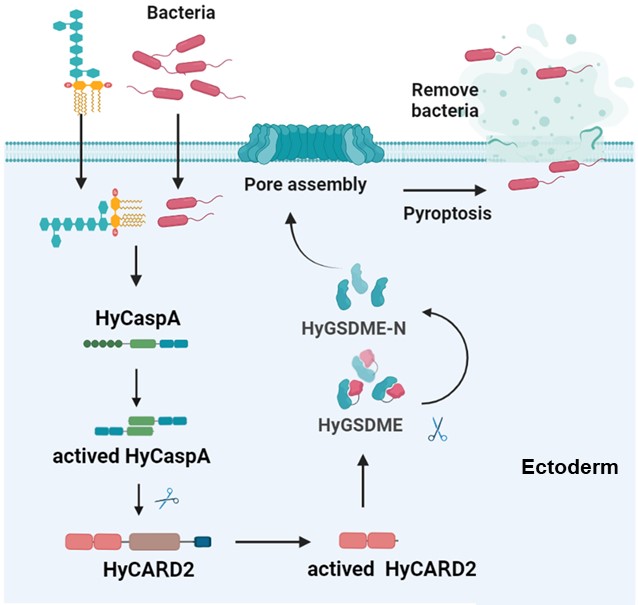
图片说明:水螅HyCaspA-HyCARD2-HyGSDME级联信号通路介导的焦亡机理图。
本研究从进化角度分析了细胞焦亡的关键执行分子GSDM各成员(GSDMA-F)在动物界的分布与保守性,发现成员GSDME是最保守的,最早可追溯至刺胞动物门。利用刺胞动物门的代表物种水螅作为模式动物,研究团队建立了LPS活体递送的动物模型,在无脊椎动物中鉴定到了LPS胞质模式识别受体HyCaspA,揭示了其独特的LPS识别功能域,解析了水螅中古老GSDME介导的保守抗感染信号通路。该研究对于认识动物界中先天免疫反应在漫长岁月中的适应和进化机制具有重要意义,也为针对细胞焦亡信号通路的靶向药物理性设计、革兰氏阴性菌感染机制的解析提供了新的理论动物研究模型。
我校生物工程学院博士后陈守文为论文的第一作者,刘琴教授为该论文的通讯作者。研究工作得到生物工程学院张元兴教授和阳大海教授的大力支持,并获得国家自然科学基金项目、中国博士后基金和上海奥普迈生物科技有限公司的资助。
新闻来源:华理新闻网
新闻链接:https://news.ecust.edu.cn/2023/0724/c6a174983/page.htm







